Die schweizerische Arbeitsgruppe für Peritoneale Malignome, Swiss Peritoneal Cancer Group (SPCG), veröffentlichte 2022 umfangreiche Behandlungsalgorithmen inklusive Indikationen zur zytoreduktiven Chirurgie (CRS) und hyperthermen intraperitonealen Chemotherapie (HIPEC) bei gastrointestinalen Karzinomen. Die Peritoneal Surface Oncology Group International (PSOGI) hat nun mithilfe eines Delphi-Prozesses Konsensus-Empfehlungen zu den bevorzugten HIPEC-Regimen verschiedener peritonealer Neoplasien erarbeitet.
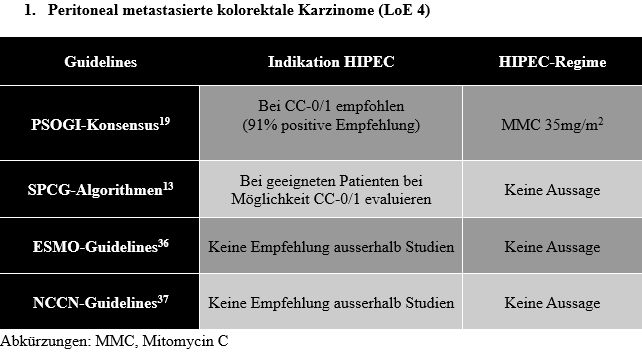
Wir haben die verfügbaren Empfehlungen der PSOGI zu peritoneal metastasiertem kolorektalem Karzinom, diffus malignem peritonealem Mesotheliom und epithelialem Ovarialkarzinom im Vergleich zu existierenden Leitlinien von SPCG, European Society for Medical Oncology (ESMO) und National Comprehensive Cancer Network (NCCN) zusammengefasst. Ein weiterer Artikel ist nach Veröffentlichung der Konsensus-Empfehlungen für peritoneal metastasiertes Magenkarzinom und Pseudomyxoma peritonei geplant.
Hintergrund
Malignome des Peritoneums bilden eine heterogene Gruppe von malignen Erkrankungen, die sich in Bezug auf Inzidenz, Empfindlichkeit gegenüber systemischen Therapien und Prognose stark voneinander unterscheiden. Ihnen gemeinsam ist die Neigung zur peritonealen Dissemination. Peritoneale Malignome können primäre Tumoren des Peritoneums sein (z.B. peritoneales Mesotheliom) oder sekundär als peritoneale Metastasen insbesondere von Tumoren mit intraperitonealem Ursprung. Bis vor einigen Jahren zählten diese Tumore zu den seltenen Erkrankungen mit begrenzten therapeutischen Möglichkeiten und einer schlechten Prognose.1
Die Hauptgründe für die reduzierten Überlebensraten dieser Patienten sind die Diagnose in einem fortgeschrittenen Stadium und das begrenzte klinische Ansprechen der meisten Entitäten auf konventionelle Therapieoptionen wie systemische Chemotherapie.2 Zu den wichtigsten Neuerungen der letzten Jahrzehnte gehören die Einführung und Weiterentwicklung der Technik der Peritonektomie sowie multiviszerale Resektion zur Erzielung einer vollständigen Zytoreduktion, definiert als Fehlen einer makroskopischen Erkrankung.3 Zudem wurde das Prinzip der intraperitonealen Chemotherapie zur Behandlung mikroskopischer Resterkrankungen entwickelt. 4,5
Im Zuge dieser Entwicklungen hat sich das Überleben von Patienten mit peritonealen Metastasen, die mit einer Kombination aus lokoregionaler und systemischer Therapie behandelt wurden, im Vergleich zur historischen palliativen Therapie deutlich verbessert.6,7 Zu den Hauptgründen für diesen Trend zählt die steigende Zahl an Patienten, die sich einer CRS verbunden mit einer HIPEC unterziehen.8 Die zytoreduktive Chirurgie ist zweifelsfrei die wichtigste Komponente der kurativen Behandlung bei Malignomen des Peritoneums und zielt auf die Resektion aller sichtbaren Tumorimplantate ab. Es erfolgt zunächst eine ausführliche Exploration der Peritonealhöhle, um das Ausmass der Erkrankung mithilfe des Peritonealkarzinose-Index (PCI) zu beurteilen.9
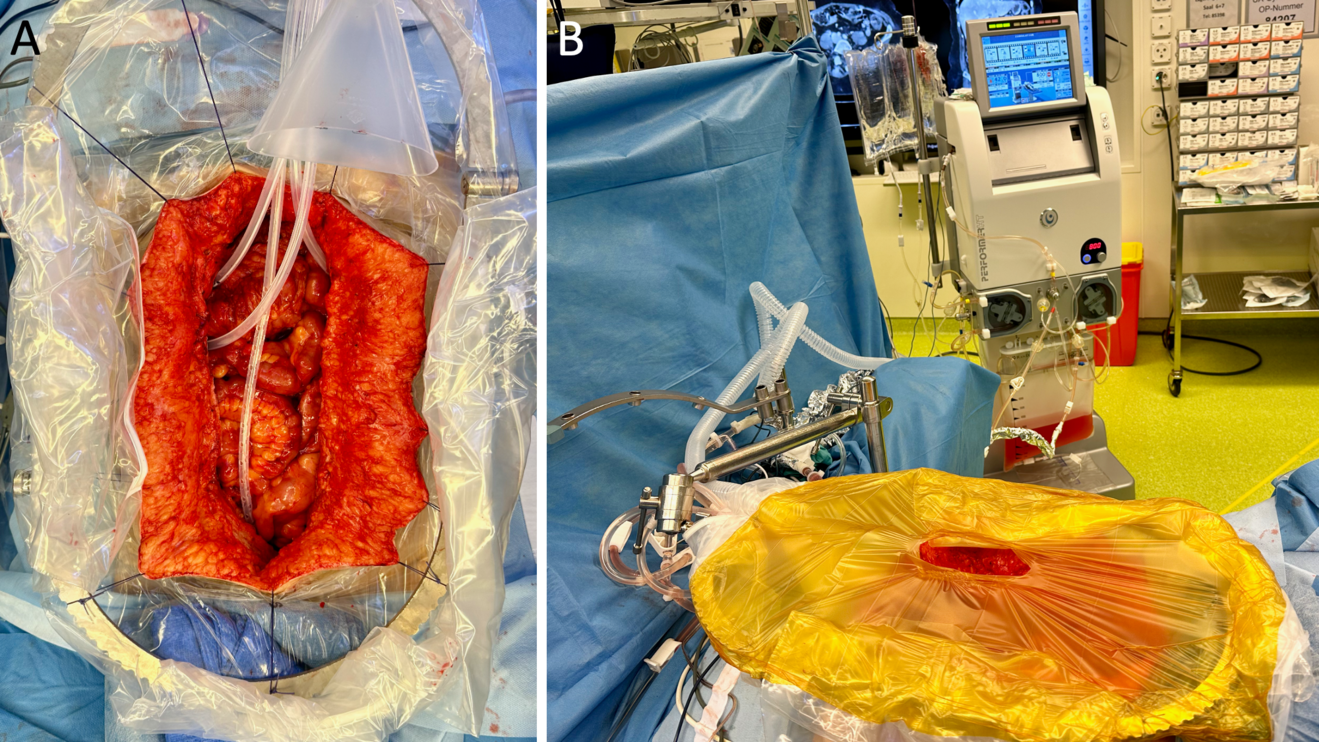
Je nach Entität gibt es unterschiedliche Empfehlungen bis zu welchem maximalen PCI eine zytoreduktive Therapie sinnvoll erscheint. Am Ende der Operation muss die Vollständigkeit der Zytoreduktion gemäss dem CC-Score (CC-0, kein Restknoten; CC-1, <2,5 mm; CC-2, <25 mm; und CC-3, >25 mm) bestimmt werden. Wenn eine vollständige Resektion erreicht wurde, kann bei ausgewählten Patienten unmittelbar am Ende der zytoreduktiven Chirurgie die HIPEC eingesetzt werden zur Behandlung von mikroskopischer Resterkrankung (Abbildung 1). Das Chemotherapeutikum diffundiert dabei in mikroskopisch kleine peritoneale Karzinomherde und tritt nur zu einem sehr geringen Teil in den systemischen Blutkreislauf über, was höhere Dosen der jeweiligen Chemotherapeutika ermöglicht bei gleichzeitig geringer Rate an systemischen Nebenwirkungen im Vergleich zur systemischen Chemotherapie.10-12
Die schweizerische Arbeitsgruppe für Peritoneale Malignome, SPCG, veröffentlichte 2022 umfangreiche Behandlungsalgorithmen inklusive Indikationen zur CRS und HIPEC, welche sich im Wesentlichen mit den Richtlinien weiterer internationaler Fachgesellschaften decken.13 Dennoch gibt es international vor allem bezüglich der HIPEC-Regime der einzelnen Entitäten eine grosse Heterogenität und begrenzte Evidenz bezüglich deren Wirksamkeit.14,15 Mithilfe eines Delphi-Prozesses, bei dem internationale Experten zur verfügbaren Evidenz, Expertenmeinungen sowie Forschungsschwerpunkten befragt wurden, hat die PSOGI daher einen internationalen Konsens formuliert, welcher eine Standardisierung der HIPEC-Regime der einzelnen Malignome erreichen soll.16 Im Folgenden sind die Empfehlungen zu drei Entitäten zusammengefasst:
1. Peritoneal metastasiertes Kolonkarzinom
Neu diagnostizierte kolorektale Karzinome weisen in 4–15% synchrone, peritoneale Metastasen auf, etwa 25% entwickeln im Rezidivfall peritoneale Metastasen.17 Das mittlere Gesamtüberleben nach multimodaler Therapie, inklusive CRS mit und ohne HIPEC, liegt aktuell bei 41.7 Monaten im Vergleich zu 16.3 Monaten bei alleiniger palliativer Chemotherapie ((Level of Evidence (LoE) 1b) (Abbildung 2)).18,19 Im Rahmen der PRODIGE-7-Studie konnte die hochdosierte/kurzzeitige Oxaliplatin-haltige HIPEC keinen Überlebensvorteil im Vergleich zu alleiniger CRS zeigen (Gesamtüberleben 41.7 Monate nach CRS + HIPEC vs. 41.2 Monate nach alleiniger CRS), weshalb dieses Regime nicht mehr empfohlen wird.18 Das Expertengremium kam einstimmig zu dem Schluss, dass die HIPEC mit anderen Schemata als dem Oxaliplatin-Regime aus PRODIGE 7 immer noch eine praktikable Behandlungsstrategie für Patienten mit vollständig resezierbaren isolierten peritonealen Metastasen sein kann. Aufgrund günstigem Nebenwirkungsprofil ist das holländische Hochdosis Mitomycin C (MMC)-basierte HIPEC-Regime von 35mg/m2 MMC in drei Fraktionen (1/2 Dosis bei Start, jeweils ¼ der Gesamtdosis Dosis nach 30 und 60 Minuten) über 90 Minuten bei 41–43°C aktuell das von der PSOGI bevorzugte Regime, sowohl primär als auch im Falle eines Rezidivs.5,19
Die Tumorbiologie und die Möglichkeit der kompletten Zytoreduktion sollten bei der Indikationsstellung unbedingt berücksichtigt werden.20 Es werden weitere randomisiert kontrollierte Studien (RCT) benötigt, die die CRS mit MMC-basierter HIPEC mit der alleinigen CRS vergleichen. Aktuell läuft eine randomisierte Studie in den Niederlanden, welche den Effekt einer perioperativen Chemotherapie bei CRS + HIPEC mit „upfront“ CRS + HIPEC auf das Gesamtüberleben vergleicht (CAIRO-6 Trial).21 Den Stellenwert der prophylaktischen HIPEC hat eine kürzlich veröffentlichte randomisierte Studie aus Spanien erneut untersucht. Hier zeigte sich, dass bei lokal fortgeschrittenem Kolonkarzinom (Stadium T4) das Auftreten eines Lokalrezidivs oder peritonealer Metastasen nach drei Jahren durch eine prophylaktische HIPEC nach erfolgter R0-Resektion im Vergleich zur alleinigen Resektion reduziert werden kann (3-Jahres Peritonealrezidiv-freies Überleben 98.3% nach CRS + HIPEC vs. 82.1% nach alleiniger CRS).22 Die prophylaktische HIPEC ist jedoch weiterhin umstritten und sollte Gegenstand zukünftiger Studien sein.19
Die Empfehlung zur CRS bei Patienten mit kolorektalem Karzinom und begrenzter, isolierter Peritonealmetastasierung bei geeigneten Patienten ist unbestritten (LoE 1b). Der maximale PCI, bis zu welchem eine CRS bei metastasiertem kolorektalem Karzinom sinnvoll erscheint, ist nicht klar definiert, ein internationales Expertengremium mit Schweizer Beteiligung hat einen max. PCI von 15–20 vorgeschlagen (LoE 5).23 Bei selektierten Patienten kann nach vollständiger Zytoreduktion eine HIPEC erwogen werden (91% strong positive recommendation, LoE 4); das niederländische Hochdosis-MMC-Schema ist hier das bevorzugte Regime (64% strong positive recommendation). Es werden dringend weitere RCTs benötigt, welche die CRS + HIPEC mit dem MMC-basierten Regime mit alleiniger CRS vergleichen.
2. Diffuses malignes peritoneales Mesotheliom
Das diffuse, maligne, peritoneale Mesotheliom zählt zu den seltenen malignen Erkrankungen.11,24 Aufgrund der grundsätzlichen Beschränkung auf die Peritonealhöhle und Resistenz auf eine systemische Behandlung wird das primär maligne peritoneale Mesotheliom seit Jahrzehnten mit lokoregionaler Therapie behandelt.25 Inzwischen gilt CRS + HIPEC als Standardbehandlung für geeignete Patienten, da nach CRS + HIPEC ein deutlicher Überlebensvorteil von drei bis fünf Jahren im Vergleich zu einem Jahr nach einer alleinigen systemischen Behandlung erreicht wird und bei ausgewählten Patienten sogar kurative Ergebnisse erzielt werden können (LoE 2a).26-28
Im Vergleich zur kompletten Zytoreduktion ist gemäss einer multizentrischen, retrospektiven Studie das mediane Überleben nach inkompletter Zytoreduktion reduziert (medianes Überleben von 12–40 Monate bei CC-2/3 im Vergleich zu 67–94 Monate bei CC-0/1).29 Im Rahmen einer multizentrischen Studie der französischen RENAPE-group zeigte die HIPEC als Kombinationstherapie im Vergleich zur Monotherapie einen Überlebensvorteil (HR 0.53, 95% CI 0.28–1.00; p = 0.05), platinbasierte Regime hatten hier das beste Outcome.30
Als Schlussfolgerung des internationalen Konsensus nach umfassender, detaillierter Überprüfung der Literatur ist die HIPEC bei diffusem malignem Mesotheliom nach kompletter Zytoreduktion (CC-0/1) und bei wiederholter CRS + HIPEC empfohlen (88% strong positive recommendation, LoE 2a). Cisplatin-haltige HIPEC-Regime, am ehesten die Kombination aus Cisplatin 50mg/m2 und Doxorubicin 15mg/m2, seien hier zu bevorzugen (LoE 2a).11,31 Die Frage nach einer HIPEC bei inkompletter Zytoreduktion (CC-2/3) bleibt kontrovers, hier könne aufgrund der oben erwähnten limitierten Literatur mit einem Überleben von 12–40 Monaten bei CC-2/3 nach CRS + HIPEC aktuell keine eindeutige Empfehlung erfolgen (LoE 4).11,29
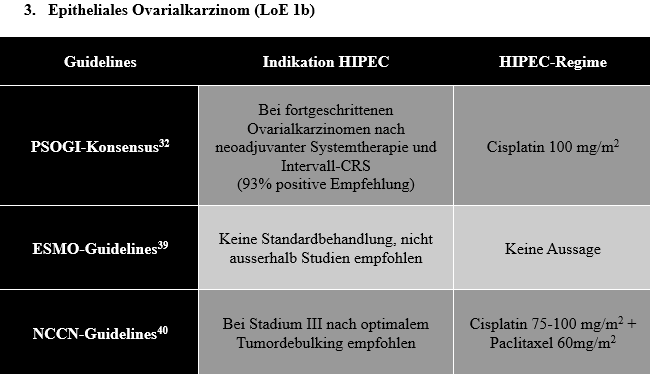
3. Epitheliales Ovarialkarzinom
Bei Patientinnen mit epithelialen Ovarialkarzinomen bestehen bei Diagnosestellung in bis zu 75% peritoneale Metastasen, die Rate peritonealer Rezidive ist ähnlich hoch.32 Die Erkrankung bleibt über längere Zeiträume auf die Peritonealhöhle beschränkt, weshalb sich die HIPEC als vielversprechende therapeutische Strategie neben der CRS etabliert hat. Nach positiven Resultaten zweier randomisiert-kontrollierter Studien, der OVHIPEC-1 Studie und der koreanischen HIPEC-Studie von Lim et al., ist die HIPEC nach neoadjuvanter Chemotherapie, nicht aber bei primärer CRS oder Rezidiv empfohlen (LoE 1b).32-35 In der OVHIPEC-1 Studie konnte für neoadjuvant vorbehandelte Patientinnen mit Stadium III Ovarialkarzinomen eine Verbesserung des medianen Gesamtüberlebens nach CRS + HIPEC von 44.9 Monaten im Vergleich zu 33.3 Monaten nach alleiniger CRS gezeigt werden.35
Dementsprechend zeigt das Ergebnis des Expertenvotums (93% strong positve recommendation) einen starken Konsens, die HIPEC mit Intervall-CRS bei fortgeschrittenen Ovarialkarzinomen zu kombinieren und dass dies als Routinebehandlung angesehen werden könnte. Als Regime der Wahl wird Cisplatin nach dem OVHIPEC-1 Regime, 100 mg/m2 Cisplatin in drei Fraktionen (1/2 Dosis bei Start, jeweils ¼ der Gesamtdosis nach 30 und 60 Minuten) über 90 Minuten bei 41–43°C, mit Natriumthiosulfat zur Nephroprotektion favorisiert.32 Weitere klinische Studien sind notwendig, um den Einsatz der HIPEC bei primärer CRS und im Rezidivfall zu evaluieren.32
Diskussion
Die Empfehlungen des vorliegenden Konsensus sowie Leitlinien/Behandlungsalgorithmen der SPCG, ESMO und NCCN sind in Tabelle 1–3 einander gegenübergestellt. Die grösste Limitation der vorliegenden Konsensus-Empfehlungen ist die begrenzte Evidenz aufgrund fehlender randomisiert kontrollierter Studien. Vor allem beim kolorektalen Karzinom sind RCTs benötigt, welche die CRS + MMC-basierte HIPEC mit alleiniger CRS vergleichen. Aufgrund der limitierten Evidenz ist ein Expertenkonsens erforderlich, um eine Orientierungshilfe für die tägliche Praxis für Patienten mit peritonealen Malignomen zu formulieren. Die Expertengremien haben sich hauptsächlich aus Experten für peritoneale Neoplasien zusammengesetzt, die die HIPEC standardmässig anwenden. Das erklärt, warum die Empfehlung für eine HIPEC insbesondere bei peritoneal metastasiertem kolorektalen Karzinom stärker war als in aktuellen Guidelines von z.B. NCCN oder ESMO.36,37 Die Datenlage habe es teilweise unmöglich gemacht zu diskriminieren, ob der beschriebene Effekt einer Studie auf die CRS oder auf die HIPEC zurückzuführen ist.11,19,32 Trotz der besagten Limitationen tragen die oben genannten Konsensus-Empfehlungen erheblich zur Standardisierung der verschiedenen HIPEC-Regime bei und stellen die aktuell am besten fundierten Empfehlungen zur CRS + HIPEC dar. Die hier zusammengefassten Konsensempfehlungen können in Ergänzung zu den von der SPCG veröffentlichten Behandlungsalgorithmen als Orientierungshilfe für die tägliche Praxis dienen, insbesondere bei der Frage der bevorzugten HIPEC-Schemata.
Tabelle 1-3: Vergleich verschiedener Guidelines zu CRS + HIPEC
1. Sadeghi B, Arvieux C, Glehen O, et al. Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer. Jan 15 2000;88(2):358-63. doi:10.1002/(sici)1097-0142(20000115)88:2<358::aid-cncr16>3.0.co;2-o
2. Cortés-Guiral D, Hübner M, Alyami M, et al. Primary and metastatic peritoneal surface malignancies. Nat Rev Dis Primers. Dec 16 2021;7(1):91. doi:10.1038/s41572-021-00326-6
3. Sugarbaker PH. Peritonectomy procedures. Ann Surg. Jan 1995;221(1):29-42. doi:10.1097/00000658-199501000-00004
4. Glehen O, Gilly FN, Boutitie F, et al. Toward curative treatment of peritoneal carcinomatosis from nonovarian origin by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy: a multi-institutional study of 1,290 patients. Cancer. Dec 15 2010;116(24):5608-18. doi:10.1002/cncr.25356
5. Van der Speeten K, Lemoine L, Sugarbaker P. Overview of the optimal perioperative intraperitoneal chemotherapy regimens used in current clinical practice. Pleura Peritoneum. Jun 1 2017;2(2):63-72. doi:10.1515/pp-2017-0003
6. Verwaal VJ, van Ruth S, de Bree E, et al. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin Oncol. Oct 15 2003;21(20):3737-43. doi:10.1200/jco.2003.04.187
7. Ishigami H, Fujiwara Y, Fukushima R, et al. Phase III Trial Comparing Intraperitoneal and Intravenous Paclitaxel Plus S-1 Versus Cisplatin Plus S-1 in Patients With Gastric Cancer With Peritoneal Metastasis: PHOENIX-GC Trial. J Clin Oncol. Jul 1 2018;36(19):1922-1929. doi:10.1200/jco.2018.77.8613
8. van Driel WJ, Koole SN, Sonke GS. Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer. N Engl J Med. Apr 5 2018;378(14):1363-1364. doi:10.1056/NEJMc1802033
9. Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treat Res. 1996;82:359-74. doi:10.1007/978-1-4613-1247-5_23
10. Dedrick RL. Theoretical and experimental bases of intraperitoneal chemotherapy. Semin Oncol. Sep 1985;12(3 Suppl 4):1-6.
11. Kepenekian V, Sgarbura O, Marchal F, Villeneuve L, Kusamura S, Deraco M. 2022 PSOGI Consensus on HIPEC Regimens for Peritoneal Malignancies: Diffuse Malignant Peritoneal Mesothelioma. Ann Surg Oncol. Nov 2023;30(12):7803-7813. doi:10.1245/s10434-023-13973-8
12. Filis P, Mauri D, Markozannes G, Tolia M, Filis N, Tsilidis K. Hyperthermic intraperitoneal chemotherapy (HIPEC) for the management of primary advanced and recurrent ovarian cancer: a systematic review and meta-analysis of randomized trials. ESMO Open. Oct 2022;7(5):100586. doi:10.1016/j.esmoop.2022.100586
13. Adamina M, Warlaumont M, Berger MD, et al. Comprehensive Treatment Algorithms of the Swiss Peritoneal Cancer Group for Peritoneal Cancer of Gastrointestinal Origin. Cancers (Basel). Sep 1 2022;14(17)doi:10.3390/cancers14174275
14. Lemoine L, Sugarbaker P, Van der Speeten K. Drugs, doses, and durations of intraperitoneal chemotherapy: standardising HIPEC and EPIC for colorectal, appendiceal, gastric, ovarian peritoneal surface malignancies and peritoneal mesothelioma. International Journal of Hyperthermia. 2017/07/04 2017;33(5):582-592. doi:10.1080/02656736.2017.1291999
15. Bhatt A, de Hingh I, Van Der Speeten K, et al. HIPEC Methodology and Regimens: The Need for an Expert Consensus. Annals of Surgical Oncology. 2021/12/01 2021;28(13):9098-9113. doi:10.1245/s10434-021-10193-w
16. Kusamura S, Bhatt A, Hubner M, et al. The 2022 PSOGI International Consensus on HIPEC Regimens for Peritoneal Malignancies: Methodology. Ann Surg Oncol. Apr 2023;30(4):2508-2519. doi:10.1245/s10434-022-12990-3
17. Cortés-Guiral D, Hübner M, Alyami M, et al. Primary and metastatic peritoneal surface malignancies. Nature Reviews Disease Primers. 2021/12/16 2021;7(1):91. doi:10.1038/s41572-021-00326-6
18. Quénet F, Elias D, Roca L, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy versus cytoreductive surgery alone for colorectal peritoneal metastases (PRODIGE 7): a multicentre, randomised, open-label, phase 3 trial. The Lancet Oncology. 2021;22(2):256-266. doi:10.1016/S1470-2045(20)30599-4
19. Hübner M, van Der Speeten K, Govaerts K, et al. 2022 Peritoneal Surface Oncology Group International Consensus on HIPEC Regimens for Peritoneal Malignancies: Colorectal Cancer. Ann Surg Oncol. Nov 8 2023;doi:10.1245/s10434-023-14368-5
20. Votanopoulos KI. Repeat CRS/HIPEC: It Comes Down to Tumor Biology and Ability to Achieve a Complete CRS. Annals of Surgical Oncology. 2022/06/01 2022;29(6):3366-3368. doi:10.1245/s10434-022-11429-z
21. Rovers KP, Bakkers C, Simkens G, et al. Perioperative systemic therapy and cytoreductive surgery with HIPEC versus upfront cytoreductive surgery with HIPEC alone for isolated resectable colorectal peritoneal metastases: protocol of a multicentre, open-label, parallel-group, phase II-III, randomised, superiority study (CAIRO6). BMC Cancer. Apr 25 2019;19(1):390. doi:10.1186/s12885-019-5545-0
22. Arjona-Sánchez A, Espinosa-Redondo E, Gutiérrez-Calvo A, et al. Efficacy and Safety of Intraoperative Hyperthermic Intraperitoneal Chemotherapy for Locally Advanced Colon Cancer: A Phase 3 Randomized Clinical Trial. JAMA Surg. Jul 1 2023;158(7):683-691. doi:10.1001/jamasurg.2023.0662
23. Steffen T, Eden J, Bijelic L, et al. Patient Selection for Hyperthermic Intraperitoneal Chemotherapy in Patients With Colorectal Cancer: Consensus on Decision Making Among International Experts. Clin Colorectal Cancer. Dec 2020;19(4):277-284. doi:10.1016/j.clcc.2020.06.010
24. Park BJ, Alexander HR, Libutti SK, et al. Treatment of Primary Peritoneal Mesothelioma by Continuous Hyperthermic Peritoneal Perfusion (CHPP). Annals of Surgical Oncology. 1999/09/01 1999;6(6):582-590. doi:10.1007/s10434-999-0582-6
25. Deraco M, Casali P, Inglese MG, et al. Peritoneal mesothelioma treated by induction chemotherapy, cytoreductive surgery, and intraperitoneal hyperthermic perfusion. J Surg Oncol. Jul 2003;83(3):147-53. doi:10.1002/jso.10255
26. Kusamura S, Kepenekian V, Villeneuve L, et al. Peritoneal mesothelioma: PSOGI/EURACAN clinical practice guidelines for diagnosis, treatment and follow-up. Eur J Surg Oncol. Jan 2021;47(1):36-59. doi:10.1016/j.ejso.2020.02.011
27. Verma V, Sleightholm RL, Rusthoven CG, et al. Malignant Peritoneal Mesothelioma: National Practice Patterns, Outcomes, and Predictors of Survival. Ann Surg Oncol. Jul 2018;25(7):2018-2026. doi:10.1245/s10434-018-6499-1
28. Helm JH, Miura JT, Glenn JA, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma: a systematic review and meta-analysis. Ann Surg Oncol. May 2015;22(5):1686-93. doi:10.1245/s10434-014-3978-x
29. Yan TD, Deraco M, Baratti D, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma: multi-institutional experience. J Clin Oncol. Dec 20 2009;27(36):6237-42. doi:10.1200/jco.2009.23.9640
30. Malgras B, Gayat E, Aoun O, et al. Impact of Combination Chemotherapy in Peritoneal Mesothelioma Hyperthermic Intraperitoneal Chemotherapy (HIPEC): The RENAPE Study. Ann Surg Oncol. Oct 2018;25(11):3271-3279. doi:10.1245/s10434-018-6631-2
31. Kepenekian V, Sgarbura O, Marchal F, et al. Peritoneal Mesothelioma: Systematic Review of Hyperthermic Intraperitoneal Chemotherapy (HIPEC) Protocol Outcomes. Indian J Surg Oncol. Jun 2023;14(Suppl 1):39-59. doi:10.1007/s13193-023-01728-6
32. Bhatt A, Glehen O, Zivanovic O, et al. The 2022 PSOGI International Consensus on HIPEC Regimens for Peritoneal Malignancies: Epithelial Ovarian Cancer. Ann Surg Oncol. Dec 2023;30(13):8115-8137. doi:10.1245/s10434-023-13932-3
33. van Driel WJ, Koole SN, Sikorska K, et al. Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer. New England Journal of Medicine. 2018;378(3):230-240. doi:10.1056/NEJMoa1708618
34. Lim MC, Chang S-J, Park B, et al. Survival After Hyperthermic Intraperitoneal Chemotherapy and Primary or Interval Cytoreductive Surgery in Ovarian Cancer: A Randomized Clinical Trial. JAMA Surgery. 2022;157(5):374-383. doi:10.1001/jamasurg.2022.0143
35. Aronson SL, Lopez-Yurda M, Koole SN, et al. Cytoreductive surgery with or without hyperthermic intraperitoneal chemotherapy in patients with advanced ovarian cancer (OVHIPEC-1): final survival analysis of a randomised, controlled, phase 3 trial. Lancet Oncol. Oct 2023;24(10):1109-1118. doi:10.1016/s1470-2045(23)00396-0
36. Cervantes A, Adam R, Roselló S, et al. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. Jan 2023;34(1):10-32. doi:10.1016/j.annonc.2022.10.003
37. Benson AB, Venook AP, Al-Hawary MM, et al. Colon Cancer, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. Mar 2 2021;19(3):329-359. doi:10.6004/jnccn.2021.0012
38. Ettinger DS, Wood DE, Stevenson J, et al. Mesothelioma: Peritoneal, Version 2.2023, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. Sep 2023;21(9):961-979. doi:10.6004/jnccn.2023.0045
39. González-Martín A, Harter P, Leary A, et al. Newly diagnosed and relapsed epithelial ovarian cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. Oct 2023;34(10):833-848. doi:10.1016/j.annonc.2023.07.011
40. Armstrong DK, Alvarez RD, Bakkum-Gamez JN, et al. Ovarian Cancer, Version 2.2020, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. Feb 2 2021;19(2):191-226. doi:10.6004/jnccn.2021.0007