Die Leitlinie wird regelmässig aktualisiert auf der Basis aktueller Publikationen relevanter Studien und neuer Erkenntnisse gemäss des Ansatzes einer «Living Guideline» (1–3). Die aktuelle vierte Version wurde im Juni 2023 publiziert und ist maximal vier Jahre gültig. Im europäischen Raum und der Schweiz sind auch die ESMO Guidelines von Relevanz, eine aktualisierte Version dieser europäischen Leitlinie wurde 2022 publiziert (4). In diesem Artikel fassen wir die wichtigsten, für die Chirurgie relevanten Änderungen der letzten Jahre zusammen ((siehe auch Chevallay et al., Rev Med Suisse, 2023 (5)).
Die deutschen S3-Leitlinien sind evidenzbasierte, klinische Empfehlungen und Handlungsanweisungen, die von Expertengruppen entwickelt werden, um eine qualitativ hochwertige medizinische Versorgung sicherzustellen. Diese Leitlinien sind ein Instrument der medizinischen Qualitätssicherung. Die Geschichte dieser Leitlinien reicht bis in die 1990er-Jahre zurück, als das Konzept der evidenzbasierten Medizin (EBM) weltweit an Bedeutung gewann. Die EBM setzt auf wissenschaftliche Erkenntnisse und klinische Studien als Grundlage für medizinische Entscheidungen und Behandlungsempfehlungen. Um diese Prinzipien in der deutschen Medizin umzusetzen, wurden die S3-Leitlinien entwickelt. Die Bezeichnung "S3" steht für die höchste Stufe der Leitlinienentwicklung in Deutschland und bedeutet, dass die Leitlinien auf einer umfassenden Analyse der aktuellen wissenschaftlichen Evidenz basieren. Sie werden von interdisziplinären Expertengruppen entwickelt, die sich aus Spezialisten aus dem jeweiligen Gebiet zusammensetzen und die verfügbaren Forschungsergebnisse und Studien sorgfältig bewerten. Die Leitlinien werden regelmässig aktualisiert, um den aktuellen Stand der Forschung widerzuspiegeln.
Präoperative Diagnostik
Alle Patienten mit neu aufgetretener Dysphagie, gastrointestinalen Blutungen sowie Gewichtsverlust und/oder Appetitverlust sollten sich einer frühzeitigen Endoskopie des oberen Verdauungstrakts unterziehen. Bezüglich der weiterführenden Diagnostik haben sich folgende Änderungen durchgesetzt:
- Die Endosonographie hat sich als äusserst nützlich erwiesen für die genauere Beurteilung der T-Kategorie sowie das lokale N-Staging und sollte Bestandteil des Stagings bei Patienten mit kurativer Therapieintention sein.
- Die Positronenemissionstomographie-Computertomographie (PET-CT) wird zur Metastasensuche bei cT2–4- und cN+-Tumoren empfohlen. Die diagnostische Laparoskopie ist bei Adenokarzinomen des ösophagogastralen Übergangs (AEG) wichtig, um Leber- oder peritoneale Metastasen bei cT3/cT4-Kategorien auszuschliessen.
- Für Plattenepithelkarzinome des Ösophagus ist die Bestimmung der PD-L1-Expression durch die Immunhistochemie (IHC) ein validierter prädiktiver Biomarker für die Immuntherapie und sollte daher durchgeführt werden (6).
Die Beurteilung einer „Vollremission“ nach neoadjuvanter Tumorbehandlung ist mit den gegenwärtigen Untersuchungsverfahren nicht mit ausreichender Sicherheit möglich. Post-therapeutische Veränderungen wie Nekrosen oder Narben und entzündliche lokale Faktoren können zu falsch positiven Ergebnissen führen (7). Aktuell laufen randomisierte, kontrollierte Studien, die Aufschluss zur Rolle der aktiven Überwachung bei diesen Patienten liefern (SANO, SAKK PRODIGE 32, ESORES) werden.
Bei einliegendem selbstexpandierendem Metallstent (SEMS) sollte eine simultane perkutane Radiotherapie vermieden werden, da dies mit einer erhöhten Komplikationsrate einhergeht. In einer retrospektiven Arbeit mit 997 Patienten zeigte sich eine Radiochemotherapie als einziger Risikofaktor für eine Stent-assoziierte Komplikation (8). Es scheint dadurch zu einer signifikant erhöhten Rate an Fisteln zu kommen (9).
Chirurgische Therapie
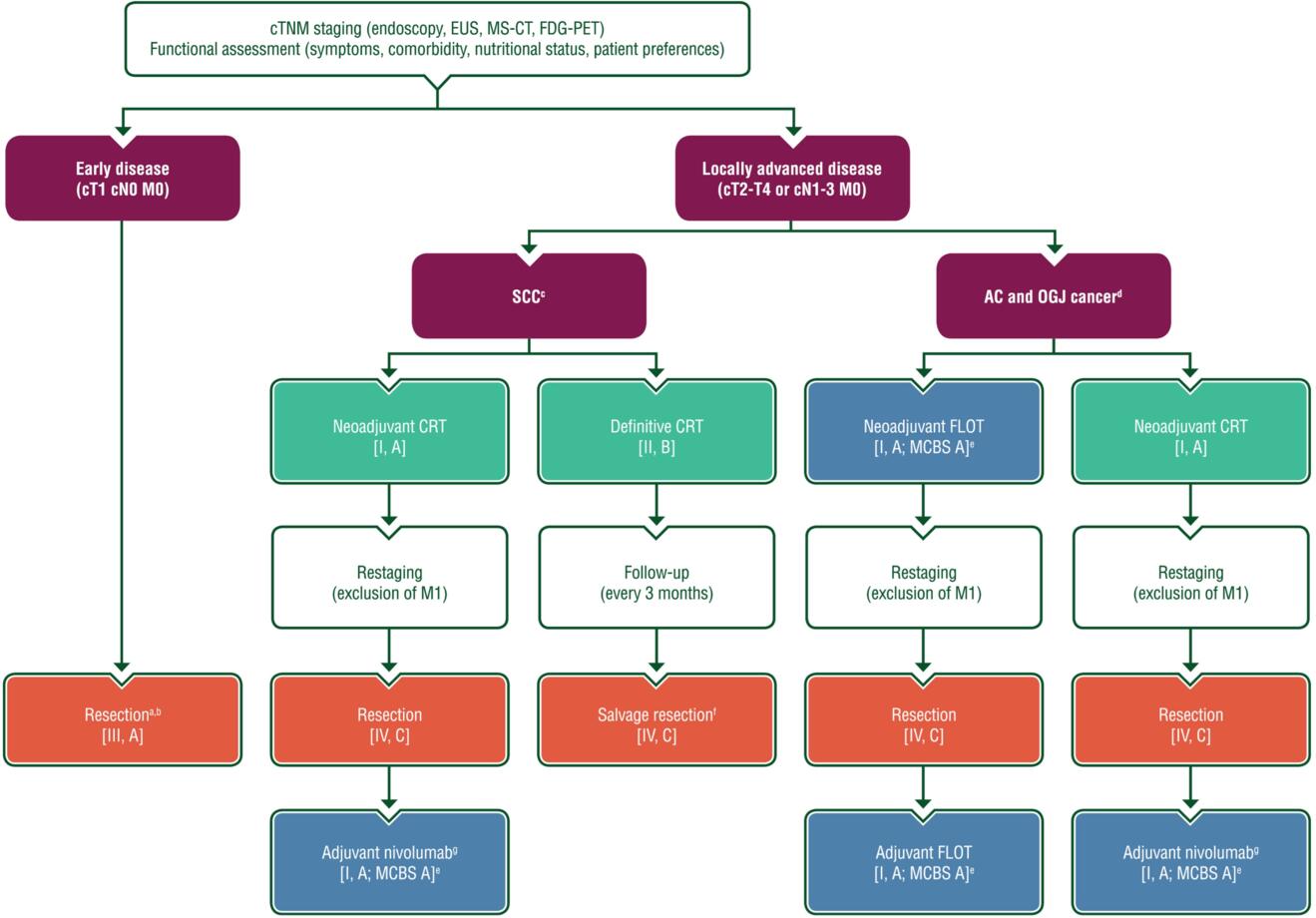
Die Chirurgie bleibt weiterhin das Rückgrat der kurativen Behandlung des lokal fortgeschrittenen, resektablen Ösophaguskarzinoms (cT2-T4a oder cN1-3), obwohl insbesondere beim Plattenepithelkarzinom eine definitive Radiochemotherapie mit Überwachung und eine erforderliche Salvage-Ösophagektomie zur lokalen Tumorkontrolle ebenfalls eine Option ist (4). Des Weiteren wird empfohlen, dass die Chirurgie in spezialisierten Zentren durchgeführt wird. Für Plattenepithel- und Adenokarzinome im mittleren und distalen Drittel des Ösophagus ist die transthorakale, subtotale Ösophagektomie mit 2-Feld-Lymphadenektomie die bevorzugte Behandlungsmethode. Bei Adenokarzinomen des ösophagogastralen Übergangs Typ III wird die transhiatale, erweiterte totale Gastrektomie mit distaler Ösophagusresektion empfohlen. Der AEG Typ II kann entweder mit der totalen Gastrektomie, transthorakalen subtotalen Ösophagektomie oder transhiatalen abdominozervikalen subtotalen Ösophagektomie behandelt werden, abhängig von der Tumorinfiltration. Wobei aktuell die Mehrzahl der Zentren eine subtotale Ösophagektomie mit einer proximalen Magenresektion bevorzugt (Abbildung 1).
Limitierte Resektionen
In Fällen von AEG-Tumoren mit cT1 (evtl. cT2) cN– ohne Risikokonstellation (G1, G2, intestinaler Typ, kein Siegelringzellkarzinom bzw. "poorly cohesive carcinoma") kann eine eingeschränkte Resektion ausreichend sein. Daten aus Japan weisen hier bei AEG-Tumoren mit < 4 cm Durchmesser eine sehr geringe Rate an Lymphknotenmetastasen von nur 1–2 % am distalen Magen aus (10). Kurzzeitdaten aus einer randomisierten Studie zu dieser Frage aus Korea stehen bereits zur Verfügung und onkologische Langzeitdaten werden weiteren Aufschluss liefern (11). Aktuell belegt jedoch noch keine Studie eine Verbesserung der Lebensqualität bei eingeschränkten Resektionen gegenüber einer klassischen Resektion.
Minimal-invasive Techniken
Bei den minimal-invasiven Verfahren, einschliesslich Hybridverfahren (Laparoskopie und Thorakotomie) und total minimal-invasiven Verfahren mit robotischer Technik, hat es eine Leitlinienanpassung gegeben. Diese haben aufgrund einer geringeren Rate postoperativer Komplikationen klare Vorteile gegenüber der offenen Ösophagektomie und werden nun klar empfohlen. In Bezug auf onkologische Endpunkte wie freie Resektionsränder, die Anzahl der entnommenen Lymphknoten und das Überleben scheinen die Ergebnisse mindestens nicht unterlegen gegenüber der offenen Ösophagektomie zu sein (12, 13). Die total minimal-invasive Ösophagektomie weist jedoch eine höhere Anastomoseninsuffizienzrate auf.
Oligometastasierung
Bei präoperativem Nachweis von Fernmetastasen soll keine Operation erfolgen. Bei intraoperativem Befund vorher nicht bekannter, sehr limitierter Fernmetastasen können diese zusammen mit dem Primärtumor entfernt werden. In der AIO-FLOT 3 Studie profitierte die kleine Gruppe der Patienten mit begrenzt metastasierten AEG-Tumoren von einer Resektion von Tumor und Metastasen nach einer neoadjuvanten Chemotherapie (14). Weitere prospektive Daten sowie die Ergebnisse der randomisierten RENAISSANCE-Studie werden hier weiteren Aufschluss liefern (15).
Postoperative Therapie
Nach Ösophagusresektion sollte aufgrund des metabolischen Risikos innerhalb von 24 h mit einer enteralen Ernährung begonnen werden, wenn der klinische Zustand des Patienten dies erlaubt. Eine parenterale Supplementierung kann empfohlen werden, wenn weniger als 50 % der Energiemenge auf enteralem Weg zugeführt werden kann. Die Vorteile einer enteralen Ernährung sind in mehreren Metaanalysen im Hinblick auf eine Verminderung der Infektionsrate, der Krankenhausverweildauer und sogar der Mortalität gezeigt worden (16).
Wenn nach neoadjuvanter Radiochemotherapie und R0 Resektion eines Ösophaguskarzinoms im Resektat histologisch noch ein Resttumorbefund nachgewiesen werden kann (≥ ypT1 oder ≥ ypN1), sollte eine adjuvante Immuntherapie durchgeführt werden. Die Checkmate 577 Studie hat hier eine Verdoppelung des rezidivfreien Überlebens gezeigt, wenn Patienten postoperativ während einem Jahr mit einem Checkpoint-Inhibitor behandelt wurden (17).
Diese Zusammenfassung bietet einen Überblick über die wichtigsten Empfehlungen und Entwicklungen in der Leitlinie im Hinblick auf die chirurgische Behandlung von Ösophaguskarzinomen.
- Hölscher AH, Gockel I, Porschen R. [Updated German S3 guidelines on esophageal cancer and supplements from a surgical perspective]. Chirurg. 2019 May;90(5):398–402.
- Porschen R, Langer T, Leeuwen P van. Leitlinienreport der S3-Leitlinie Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus. Z Gastroenterol. 2023 Jun;61(6):e308–46.
- Langer T. Konsultationsfassung Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus. 2023;
- Obermannová R, Alsina M, Cervantes A, Leong T, Lordick F, Nilsson M, et al. Oesophageal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Oct;33(10):992–1004.
- Chevallay M, Brasset C, Marcelis J, Toso C, Jung M, Mönig SP. [Esophageal cancer: standards and innovations in multidisciplinary treatment]. Rev Med Suisse. 2023 Jun 14;19(831):1169–74.
- Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016 Nov 10;375(19):1823–33.
- Eyck BM, Onstenk BD, Noordman BJ, Nieboer D, Spaander MCW, Valkema R, et al. Accuracy of Detecting Residual Disease After Neoadjuvant Chemoradiotherapy for Esophageal Cancer: A Systematic Review and Meta-analysis. Ann Surg. 2020 Feb;271(2):245–56.
- Reijm AN, Didden P, Schelling SJC, Siersema PD, Bruno MJ, Spaander MCW. Self-expandable metal stent placement for malignant esophageal strictures - changes in clinical outcomes over time. Endoscopy. 2019 Jan;51(1):18–29.
- Lu YF, Chung CS, Liu CY, Shueng PW, Wu LJ, Hsu CX, et al. Esophageal Metal Stents with Concurrent Chemoradiation Therapy for Locally Advanced Esophageal Cancer: Safe or Not? Oncologist. 2018 Dec;23(12):1426–35.
- Yamashita H, Seto Y, Sano T, Makuuchi H, Ando N, Sasako M, et al. Results of a nation-wide retrospective study of lymphadenectomy for esophagogastric junction carcinoma. Gastric Cancer. 2017 Mar 1;20(1):69–83.
- Hwang SH, Park DJ, Kim HH, Hyung WJ, Hur H, Yang HK, et al. Short-Term Outcomes of Laparoscopic Proximal Gastrectomy With Double-Tract Reconstruction Versus Laparoscopic Total Gastrectomy for Upper Early Gastric Cancer: A KLASS 05 Randomized Clinical Trial. Journal of Gastric Cancer. 2022 Apr 1;22(2):94–106.
- Mariette C, Markar SR, Dabakuyo-Yonli TS, Meunier B, Pezet D, Collet D, et al. Hybrid Minimally Invasive Esophagectomy for Esophageal Cancer. New England Journal of Medicine. 2019 Jan 10;380(2):152–62.
- van der Sluis PC, van der Horst S, May AM, Schippers C, Brosens LAA, Joore HCA, et al. Robot-assisted Minimally Invasive Thoracolaparoscopic Esophagectomy Versus Open Transthoracic Esophagectomy for Resectable Esophageal Cancer: A Randomized Controlled Trial. Annals of Surgery. 2019 Apr;269(4):621.
- Al-Batran SE, Homann N, Pauligk C, Illerhaus G, Martens UM, Stoehlmacher J, et al. Effect of Neoadjuvant Chemotherapy Followed by Surgical Resection on Survival in Patients With Limited Metastatic Gastric or Gastroesophageal Junction Cancer: The AIO-FLOT3 Trial. JAMA Oncol. 2017 Sep 1;3(9):1237–44.
- Al-Batran SE, Goetze TO, Mueller DW, Vogel A, Winkler M, Lorenzen S, et al. The RENAISSANCE (AIO-FLOT5) trial: effect of chemotherapy alone vs. chemotherapy followed by surgical resection on survival and quality of life in patients with limited-metastatic adenocarcinoma of the stomach or esophagogastric junction – a phase III trial of the German AIO/CAO-V/CAOGI. BMC Cancer. 2017 Dec 28;17:893.
- Berkelmans GHK, Fransen LFC, Dolmans-Zwartjes ACP, Kouwenhoven EA, van Det MJ, Nilsson M, et al. Direct Oral Feeding Following Minimally Invasive Esophagectomy (NUTRIENT II trial): An International, Multicenter, Open-label Randomized Controlled Trial. Ann Surg. 2020 Jan;271(1):41–7.
- Kelly RJ, Ajani JA, Kuzdzal J, Zander T, Van Cutsem E, Piessen G, et al. Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. New England Journal of Medicine. 2021 Apr 1;384(13):1191–203.